La enfermedad de Alzheimer es la responsable del 50-70% de los casos de demencia en todo el mundo y afecta a unos 50 millones de personas. La Sociedad Española de Neurología (SEN) estima que solo España hay más de 800.000 personas diagnosticadas que padecen esta enfermedad. Mientras las cifras aumentan se están investigando más de 100 compuestos y entre los laboratorios que están apostando por esta enfermedad neurodegenerativa están Biogen, Lilly, Roche, Almirall y Grifols, siendo españolas estas dos últimas.
MOLÉCULAS CONTRA EL ALZHÉIMER
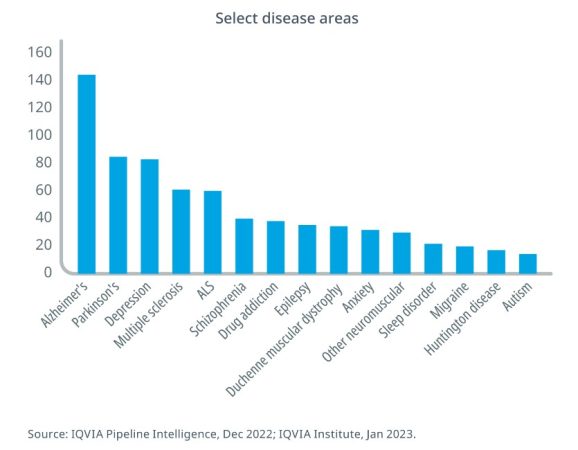
El informe Global Trends in R&D 2023, elaborado por la consultora especializada Iqvia y publicado en febrero de 2023, muestra que de las 699 moléculas en investigación en el área neurológica, gran parte están dedicadas a la enfermedad de Alzheimer, con 127 productos (seguida de la enfermedad de Parkinson, con 96). Sin embargo, hasta el momento, el arsenal terapéutico para el alzhéimer «se centra en el manejo de los síntomas con algunas excepciones, pues ya se están avanzando en fármacos que parecen frenar su avance».
Como denominador común de estos fármacos hay que matizar que no curan la enfermedad, sino que ralentizan su progresión, lo cual es un paso importante pues puede contribuir a mejora la calidad de vida de los afectados, entre otros aspectos.
El primero de estos medicamentos fue aducanumab, lanzado con el nombre comercial Aduhelm, de la farmacéutica estadounidense Biogen.
El primero de estos medicamentos fue aducanumab, lanzado con el nombre comercial Aduhelm, de la farmacéutica estadounidense Biogen. La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés), lo aprobó por la vía acelerada en junio de 2021. A pesar de ello, los expertos de este organismo pusieron en duda que aducanumab permitiera realmente paliar el curso de la enfermedad y por este motivo se solicitaron más estudios clínicos. Por su parte, la Agencia Europea del Medicamento (EMA, por sus siglas en inglés), rechazó su comercialización como tratamiento para la enfermedad de Alzheimer en diciembre de 2021.
La agencia alegó que los estudios en fase III «no demostraban que aducanumab fuera efectivo para el tratamiento de personas en fases iniciales de la enfermedad de Alzheimer». Biogen, solicitó la revisión de la decisión de la EMA y en abril de 2022, esta empresa farmacéutica anunció que retiraba la solicitud de comercialización del producto en Europa. Posteriormente, en un comunicado a sus inversores, Biogen decidió desmantelar la estructura comercial creada para apoyar al Aduhelm y a día de hoy el fármaco ya no está en el mercado.
Aducanumab fue la primera terapia en demostrar que la eliminación de la beta-amiloide del cerebro reduce el deterioro cognitivo y funcional en las personas que viven con un alzhéimer temprano.
Aducanumab fue la primera terapia en demostrar que la eliminación de la proteína beta-amiloide del cerebro reduce el deterioro cognitivo y funcional en las personas que viven con un alzhéimer temprano. Biogen fijó el precio de este medicamento en 56.000 dólares por paciente al año (una cantidad que suscitó las críticas de algunas asociaciones de la enfermedad según la Organización Sin Ánimo de Lucro, ARRP) .
EL SEGUNDO INTENTO
Posteriormente, de nuevo Biogen en colaboración con la farmacéutica japonesa Eisai presentó, en noviembre de 2022, los resultados del estudio en fase III del fármaco lecanemab (Leqembi). En enero de 2023 recibió la autorización de la FDA americana por la vía de emergencia y, a primeros de julio de este año, ha recibido la aprobación estándar. Actualmente está siendo revisado por la EMA para su autorización en Europa. Según declaraciones a MERCA2 de una de las integrantes de la Sociedad Española de Neurología (SEN), la doctora Teresa Moreno, teniendo en cuenta que en Europa y España se siguen otros plazos, se estima que no llegará a nuestro país hasta el año 2025.
Este fármaco al igual que aducanumab es un anticuerpo monoclonal que se dirige a la beta-amiloide en el cerebro. En un comunicado de prensa, los fabricantes de lecanemab anunciaron que fijarían el precio del medicamento en 26.500 dólares por paciente al año.

LILLY Y SU LANZAMIENTO
La segunda compañía farmacéutica que ha lanzado también un anticuerpo monoclonal es Lilly. Se trata de donanemab. En su ensayo de fase III se mostró que el fármaco «eliminaba mejor las placas amiloides que aducanumab y lecanemab». Este se encuentra todavía en proceso de aprobación. «La presentación a la FDA de los Estados Unidos para la aceptación de donanemab como terapia para la enfermedad de Alzheimer en estadío inicial con síntomas cognitivos leves se completó en el segundo trimestre de 2023 y se espera una decisión regulatoria para fines de este año. También se ha presentado en la UE y el Reino Unido», explican fuentes de la compañía a MERCA2.
«La presentación a la FDA de los Estados Unidos para la aprobación de donanemab se completó en el segundo trimestre de 2023 y se espera una decisión regulatoria para fines de este año
EFECTOS SECUNDARIOS
Por otro lado, cabe añadir que estos fármacos, como todos, no están exentos de efectos secundarios, y en este tipo de terapias estos incluyen anormalidades de las imágenes relacionadas con amiloide (ARIA), dolor de cabeza y peligro de caerse. «ARIA es un efecto secundario común que normalmente no causa síntomas, pero puede ser grave. Se trata de una inflamación en áreas del cerebro que normalmente se resuelve con el tiempo. Algunas personas también pueden tener manchas pequeñas de sangre en o encima de la superficie del cerebro con la inflamación. Otros síntomas vinculados a ARIA son dolor de cabeza, mareos, náusea, confusión y cambios en la visión. Otro efecto secundario grave es una reacción alérgica», tal y como cuentan desde Alzheimer’s Association.
«ARIA es un efecto secundario común que normalmente no causa síntomas, pero puede ser grave».
Para saber qué está haciendo en este sentido Lilly, MERCA2 ha preguntado a la farmacéutica y nos ha contado que como se ha observado consistentemente en ensayos clínicos en esta clase de terapias, ARIA es un riesgo que debe ser monitorizado para todas las terapias dirigidas a amiloide.
Por este motivo, han iniciado «el ensayo TRAILBLAZER-ALZ 6 con el objetivo de que proporcione una comprensión más profunda de la relación de ARIA con la reducción de amiloide, así como las características del paciente que aumentan el riesgo de ARIA».
ROCHE EN LA CARRERA
Otra de las farmacéuticas que se lanzó a esta carrera por encontrar un medicamento que frene el avance del alzhéimer es Roche. Comenzó con gantenerumab, pero al no obtener los resultados obtenidos lo desestimó y ahora se está centrando en otra terapia llamada trontinemab, que está en estudio fase I-IIb,según han indicado fuentes de la compañía a MERCA2.
Trontinemab, de Roche, está en estudio fase I-IIb.
Roche asegura que el alzhéimer sigue siendo para ellos un área terapéutica de interés. «Las recientes aprobaciones de medicamentos en esta área han sido un avance para los pacientes, pero también reflejan que todavía se necesita obtener una eficacia clínica más sólida», dicen.

ALMIRALL Y GRIFOLS, LAS ESPAÑOLAS
En España, Almirall comunicó a principios del mes de septiembre a la Comisión Nacional de Mercados de Valores (CNMV) la adquisición de los derechos exclusivos de un parche transdérmico con Rivastigmine para tratar la enfermedad de Alzheimer. El pago inicial fue de 45 millones de euros. La farmacéutica indicó que este producto le ayudará a reforzar su unidad de negocio en neurología en España.
Grifols está desarrollando el estudio AMBAR (Alzheimer Management by Albumin Replacement), un enfoque multimodal.
Por otro lado, Grifols está desarrollando el estudio AMBAR (Alzheimer Management by Albumin Replacement), un enfoque multimodal centrado igualmente en enlentecer la progresión del alzhéimer. Sus estudios tratan de demostrar que a través del recambio plasmático terapéutico se eliminan sustancias patológicas como la beta-amiloide, la proteína que se cree que contribuye al desarrollo de la enfermedad.

LOS NEURÓLOGOS
La perspectiva de los neurólogos, según Teresa Pérez, es la del optimismo. «Es cierto que a corto plazo no disponemos de productos maravillosos. En los últimos 50 años, la investigación se había basado en fármacos que suprimían la proteína beta-mieloide, que es la responsable de la eliminación de las neuronas en esta patología, y a pesar de ello no se conseguía mejora en los pacientes. Ahora, con los nuevos medicamentos se observan ciertos resultados, por lo que estamos contentos».
«Lo positivo de todo esto es que estos avances, aunque no son la panacea, permiten diversificar las vías de investigación».
En opinión de la neuróloga, la aprobación de aducanumab se hizo demasiado rápido, pero ahora la puerta se abre con el fármaco aprobado por la FDA de Biogen y Eisai, y en breve, probablemente el de Lilly. Lo positivo de todo esto, según piensa la doctora, es que estos avances, aunque no son la panacea, permiten diversificar las vías de investigación. «Lo importante es que la investigación puede progresar. Además, nos estamos dando cuenta de que las causas del alzhéimer son multifactoriales y no se deben solo a la proteína beta-mieloide, también hay déficit de oxidación, daño mitocondrial y factores de riesgo. Por ello, seguramente se necesitarán varios tratamientos».
La última duda que plantea la doctora es qué sucederá con la financiación de estos tratamientos. Por ejemplo, se estima que el coste total de lecanemab será de unos 40.000 euros al año, una cifra muy elevada teniendo en cuenta que en nuestro país hay alrededor de dos millones de personas que padecen esta enfermedad.


