Laminar Pharmaceuticals (Laminar) es una empresa biotecnológica española surgida en el año 2006 por iniciativa del doctor Pablo Escribá, su actual director general. Surgió como una spinoff de la Universidad de Baleares (UIB) y actualmente tiene su sede en Mallorca con una filial en Massachusetts (EE.UU.). Su fundador descubrió una familia de fármacos con la misma estructura y con posibilidades de desarrollo principalmente en el ámbito oncológico. Desde entonces y tras patentar la molécula, la compañía dispone del 9% de todo el pipeline de medicamentos con tecnología biotecnológica en desarrollo en España.
David Roberto García, el director financiero de Laminar, ha anunciado en exclusiva a MERCA2 que van a lanzar la que probablemente sea la última ronda de financiación del año de la compañía por un valor de 9 millones de euros para dar impulso a su prometedor LAM561, un compuesto para abordar gliomas y glioblastomas, que son un tipo de tumor cerebral. A lo largo de esta entrevista el director financiero, cuenta cómo la farmacéutica ha conseguido salir adelante durante 17 años.
ENTREVISTA LAMINAR PHARMA
Pregunta (P): ¿Cómo ha conseguido financiación la compañía a lo largo de todo este tiempo?
Respuesta (R). En todos estos años Laminar ha levantado 35 millones de euros en capital. Hasta 2020 se levantaron unos 14 millones de euros aproximadamente y entre 2021 y 2023 se ha levantado algo más de 20 millones. Ahora tenemos previsto lanzar una nueva ronda de financiación, que probablemente sea la última de este año, y en la que pretendemos levantar 8 millones de euros. La fecha estimada de cierre será el 5 de febrero.

P. ¿Con qué inversores contáis hasta ahora?
R. La patrimonial del doctor Escribá y su familia es el primer accionista a día de hoy, siendo la familia del exministro Abel Matutes la segunda que ha invertido en nuestro proyecto con un total de 6 millones de euros hasta ahora. La familia Matutes lleva cerca de 12 años con nosotros y ha supuesto un gran apoyo. Contamos además con una farmacéutica del País Vasco llamada Praxis Pharmaceutical , dos fundadores, una farmacéutica pequeña de Estados Unidos, Roth Pharma, y también ha entrado el venture capital de Ok Mobility, Ok venture, y Hoteles Universal que llevan con nosotros desde 2021. Igualmente, se ha incorporado un grupo de inversores de Alicante que ha aportado 4 millones de euros este año.
P. ¿La compañía ha intentado incorporarse al mercado bursátil?
R. La compañía ha estado desde el año 2020 con la intención de salir en el BME Growth. Considerábamos que era una opción interesante y por ello se planteó, pero llegó la COVID-19 y vimos que no era el momento. Después, lo intentamos en el Euronext, y estábamos en París a punto de prepararlo todo, pero saltó la Guerra de Ucrania, por lo que tuvimos que aparcarlo también.
Lo cierto es que debido a todas estas circunstancias muchas empresas de biotecnología han sufrido mucho. Les está costando una barbaridad obtener dinero porque el mercado se encuentra bastante parado, no obstante desde Laminar hemos sido capaces de levantar más capital que nunca especialmente en los últimos dos años. Al final, en nuestro caso la financiación se ha conseguido a través de muchos inversores pequeños y medianos, a excepción de la familia Matutes, no tenemos ningún inversor especialmente grande.

P. ¿Habéis hecho campañas de crowdfunding?
R. Sí, en total hemos hecho seis crowdfunding con la plataforma Capital Cell y hemos levantado dos millones (lo máximo) en 2019. Hay mucha gente que ha entrado con cantidades pequeñas porque les ha gustado nuestro proyecto, en total 2.350 inversores.
P. ¿Cuál es vuestro principal foco ahora y para el que se lanza esta nueva ronda de financiación?
R. Actualmente estamos centrados en un tratamiento para tumores cerebrales, en concreto, gliomas y glioblastomas, los tumores cerebrales más agresivos y comunes que hay en esta parte del cuerpo. Los pacientes diagnosticados tienen una esperanza de vida por debajo del 5% en cinco años y la esperanza media es de entre 14 y 15 meses. Existe un tratamiento desde el año 2005, el llamado Protocolo de Stupp, que implica una cirugía y quimioterapia, pero esta solo se puede recibir durante seis meses porque es muy tóxica y al final este tratamiento solo aumenta la esperanza de vida a los pacientes 10 semanas. No hay nada más, por lo que hay una necesidad clínica clarísima.
P. ¿Cuál es la novedad que aporta Laminar?
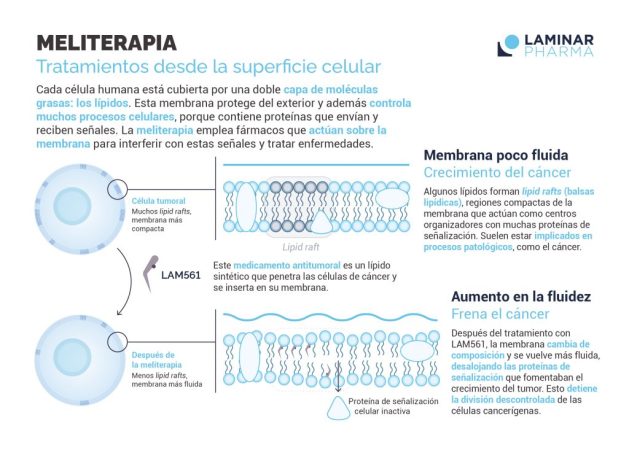
R. Nuestra aportación en este campo es el compuesto LAM561 (ácido idroxioleico, sodio), que después de completar un estudio clínico de Fase I/II ha mostrado una alentadora actividad antitumoral y un buen perfil de seguridad frente a tumores cerebrales y otros tipos de cáncer.
En el estudio se observó una respuesta prometedora en pacientes con glioma y otros tumores de alto grado, sin otras alternativas terapéuticas. De los 21 pacientes con glioma de alto grado tratados a lo largo del aumento y la expansión de la dosis, ocho (el 38,1%) tuvieron un beneficio clínico según los criterios médicos consensuados RANO (de sus siglas en inglés Response Assessment in Neuro-Oncology), con un beneficio clínico que duró al menos 6 meses en cinco pacientes, con un paciente que mostró una respuesta excepcional que duró más de 2,5 años.
Los datos de este estudio clínico demuestran que, por lo general, LAM561 tiene una tolerancia aceptable, lo cual es inusual para los medicamentos antitumorales tradicionales, que tienden a tener una alta toxicidad.
Estos resultados nos ayudaron además a que la UE, a través del Programa Horizonte 2020, nos diera a fondo perdido más de 6 millones de euros para el desarrollo de la Fase III.

P. ¿En qué momento estáis ahora?
R. Como este medicamento se encuentra en investigación no está disponible actualmente para los pacientes fuera de ensayos clínicos. Todavía hay que esperar a 2024 para obtener resultados preliminares comparativos frente a placebo y así solicitar la autorización de comercialización condicional a la EMA.
Para acelerar este proceso Laminar Pharmaceuticals ya ha recibido la designación de medicamento huérfano (medicamento para enfermedades raras con importantes necesidades terapéuticas no cubiertas) en la Unión Europea (por la EMA) y en Estados Unidos (por la FDA). Además, en EE.UU., LAM561 ha obtenido la designación Fast-Track para evaluación en el tratamiento del glioblastoma, que pretende avanzar y facilitar la evaluación y desarrollo de tratamientos prometedores. Del mismo modo, la FDA aprobó la designación de LAM561 como tratamiento candidato para Enfermedad Pediátrica Rara (RPD, en inglés), para pacientes con glioma difuso de alto grado de tipo pediátrico (pdHGG).
LAM561 se está evaluando actualmente en un estudio clínico fundamental (Fase IIb/III) y se realizará un primer análisis de los resultados a principios de 2024 por un comité independiente. Si los resultados demuestran ser clínicamente significativos, esto permitiría solicitar una autorización de comercialización.
Si los resultados del análisis intermedio muestran un beneficio clínico significativo, se podría obtener la aprobación de comercialización condicional en Europa, para pacientes con glioblastoma recién diagnosticados, durante 2024.
En la actualidad tenemos un análisis de seguridad y futilidad. Eso significa que el comité de expertos nos han facilitado además un informe que acabamos de compartir con nuestros accionistas. En este se refleja, que por un lado, nuestro medicamento no es perjudicial para los pacientes a nivel de efectos secundarios, lo cual en oncología no es nada fácil. Y en cuanto a la futilidad, es decir, si ven o no alguna diferencia, nos han dicho que no, lo que realmente significa que están viendo algo.
Además, entre abril y junio de 2024, se va a mostrar el estudio de 66 pacientes. Este es el análisis que nos pide la EMA y si sale positivo como hemos previsto esto nos permitiría solicitar la aprobación para comercializar. Pensamos hacer la aplicación para la aprobación del medicamento en Europa entre julio y agosto de 2024.
P. ¿Qué farmacéuticas han mostrado interés?
R. Están interesadas varias farmacéuticas, y muchas de ellas se encuentran entre las 10 más grandes del mundo. Hemos hecho un cambio de estrategia y ahora solo estamos hablando con las ‘top farma’ o alguna farmacéutica más pequeña pero con capacidad financiera para desarrollar un proyecto tan ambicioso como el nuestro. Algunas con las que estamos conversando son españolas y hasta ahora todo está marchando muy bien.
P. ¿Cómo está el sector de la biotecnólogas en la actualidad en España?
R. Los cierto es que cuando hay crisis o problemas de liquidez las compañías que más sufren en el campo de la investigación científica son las biotecnológicas porque nosotros no vendemos. Nosotros hemos invertido desde 2006 más de 50 millones en inversiones de capital, más becas… Aquí todo el mundo está becado. Al no vender nada si no tienes financiación estás perdido. En el caso nuestro la hemos conseguido por medio de inversores privados porque hemos generado mucha confianza a través de transparencia y comunicación. Estamos haciendo crecer el producto desde muchas vías diferentes.

España es una potencia en creación de ciencia y estamos muy valorados en el mundo pero no tenemos esa cultura de llevar a los pacientes los fármacos, que se suelen quedar en fase I o II, y después acaban en otros países. Nosotros queremos permanecer en Mallorca y continuar con nuestra planta de producción en Alicante y expandirnos en España.
P. ¿Qué otros desarrollos relevantes tenéis?
R. Tenemos un fármaco para el cáncer de páncreas en fase IIb, solo le queda la fase III, y nos va muy bien. Probablemente llegará en 2026. Igualmente, tenemos otro gran proyecto que está relacionado con la enfermedad de Alzheimer. Está prácticamente terminada la fase preclínica y seguramente la terminaremos en el año 2024 y la fase en humanos empezará entre finales de 2024 y 2025. En este caso, lo que estamos viendo además de que puede evitar la pérdida neuronal de los pacientes hemos observado la recuperación de la capacidad cognitiva. Si conseguimos la financiación que nos hace falta para desarrollar el proyecto de oncología se podría avanzar en este desarrollo.







